分子植物科學(xué)卓越創(chuàng)新中心黃偉杰研究組與合作者揭示植原體效應(yīng)蛋白SAP05介導(dǎo)非泛素化蛋白降解的結(jié)構(gòu)基礎(chǔ)
文章來(lái)源:分子植物科學(xué)卓越創(chuàng)新中心 | 發(fā)布時(shí)間:2023-12-05 | 【打印】 【關(guān)閉】
2023年12月1日,國(guó)際知名學(xué)術(shù)期刊PNAS在線發(fā)表了中國(guó)科學(xué)院分子植物科學(xué)卓越創(chuàng)新中心和英國(guó)John Innes Centre合作的題為“Bimodular Architecture of Bacterial Effector SAP05 that Drives Ubiquitin-Independent Targeted Protein Degradation”的研究論文�����。該研究揭示了植原體效應(yīng)蛋白SAP05如何同時(shí)結(jié)合植物中的靶蛋白和26S蛋白酶體上的泛素受體RPN10��,以實(shí)現(xiàn)非泛素依賴的蛋白酶體降解����。
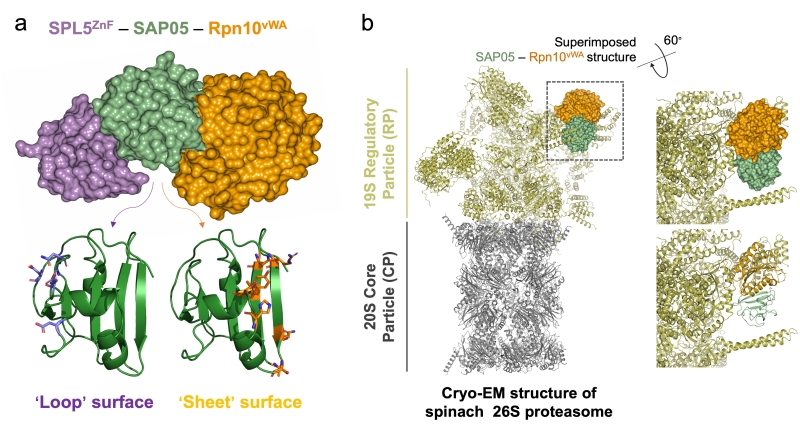
植原體是一類典型的蟲(chóng)媒細(xì)菌性病害����,由葉蟬、飛虱等刺吸式昆蟲(chóng)取食植物而傳播���,特異侵染植物的韌皮部組織�。它們能夠侵染上千種植物�,引發(fā)包括棗瘋病、泡桐叢枝病和桑萎縮病等重大病害�����。染病植物通常表現(xiàn)出花變?nèi)~(phyllody)或叢枝(Witches' broom)等癥狀��,無(wú)法正常生長(zhǎng)繁殖,從而淪為植原體滋生和蟲(chóng)媒傳播的溫床�����,又被稱為‘僵尸’植物(‘Zombie’plant)�����。在之前的研究中����,黃偉杰等人發(fā)現(xiàn)植原體的一個(gè)效應(yīng)蛋白SAP05能夠通過(guò)劫持植物26S蛋白酶體上的泛素受體RPN10,特異地降解植物中SPL和GATA兩大類調(diào)控植物發(fā)育相關(guān)的轉(zhuǎn)錄因子���,從而引發(fā)叢枝癥狀(Huang et al., 2021.Parasitic modulation of host development by ubiquitin-independent protein degradation. Cell 184, 5201–5214.)�����。本研究在此基礎(chǔ)上進(jìn)一步解析了SAP05-RPN10以及SAP05-SPL5的晶體結(jié)構(gòu)�。分析表明SAP05具有獨(dú)特的雙模塊構(gòu)型�����,其中松散的loop表面主要通過(guò)靜電作用結(jié)合轉(zhuǎn)錄因子��,而剛性的sheet表面主要通過(guò)極性作用結(jié)合RPN10(圖a)。同時(shí)���,SAP05與RPN10結(jié)合的部位背向26S蛋白酶體��,并不影響RPN10在26S蛋白酶體的組裝(圖b)�?�?偟膩?lái)說(shuō)����,本研究揭示了細(xì)菌效應(yīng)蛋白是如何繞過(guò)經(jīng)典的泛素-蛋白酶體途徑����,從而在真核細(xì)胞中實(shí)現(xiàn)非泛素依賴的靶向蛋白降解,為研發(fā)新的靶蛋白降解技術(shù)提供了一種新的思路��。
John Innes Centre Saskia Hogenhout教授�����、中國(guó)科學(xué)院分子植物科學(xué)卓越創(chuàng)新中心黃偉杰研究員為本文的共同通訊作者�。該研究得到了上海自然科學(xué)基金項(xiàng)目的資助。
論文鏈接:https://www.pnas.org/doi/10.1073/pnas.2310664120
植原體效應(yīng)蛋白SAP05三元復(fù)合體結(jié)構(gòu)